Cardiotoxicidad por quimioterapia en un paciente con linfoma B difuso de células grandes: doxorubicina o ifosfamida
RESUMEN
La cardiotoxicidad es una de las principales causas de muerte y discapacidad en los pacientes con linfoma que recibieron tratamiento con quimioterapia y/o radioterapia. La sobrevida en este tipo de neoplasias ha mejorado en la última década; se replantea la manera de evaluar y de enfrentar los efectos adversos a corto y largo plazo del tratamiento. En el caso de cardiotoxicidad por antraciclinas, a pesar de llevar muchos años conociéndola, no se tiene aún una respuesta sobre la mejor manera de predecirla o evitarla. En algunos casos, como en el tratamiento del linfoma B difuso de células grandes, sin otra especificación o el cáncer de mama, se combinan varias terapias cardiotóxicas; por lo que actualmente existe el interés en desarrollar métodos no sólo para detectar el daño de manera temprana, sino para diferenciar entre el daño producido por los diferentes componentes del tratamiento.
Palabras clave. Cáncer. Antraciclinas. Linfoma.
ABSTRACT
Cardiotoxicity is one of the main causes of death and impairment in patients with lymphoma who were treated with chemotherapy and/ or radiotherapy. The survival in this type of neoplasm has improved in the last decade, leading us to rethink the way in which we evaluate and face the short and long term adverse effects. In the case of cardiotoxicity by anthracyclines, despite knowing about it many years ago, we still have no answer on the best way to predict or prevent it. In some cases, as in the treatment of lymphoma diffuse large cell B without further specification or breast cancer, is chosen to combine several cardiotoxic therapies. Actually there is now interest in developing methods for detecting not only an early damage, but to distinguish between the damage produced by different components of the treatment.
Key words. Cancer. Anthracyclines. Lymphoma.
INTRODUCCIÓN
La relación entre el tratamiento con antraciclinas (doxorubicina, epirubicina, daunrubicina) y la cardiotoxicidad es un tema ampliamente discutido y reconocido.1 Este problema se reporta desde el inicio del uso de la doxorubicina en 1960,2 y aunque actualmente se sabe que éste es un efecto común a todo este grupo de fármacos, se desconoce la mejor manera de predecir los pacientes que sufrirán problemas cardiacos y, aún más, conocer la forma de prevenir o identificar tempranamente este daño.3
Además de las antraciclinas, consideradas el fármaco modelo en cuanto a cardiotoxicidad en ontología, muchos otros fármacos causan efectos cardiovasculares,4,5 los cuales van desde hipertensión arterial6 hasta espasmos coronarios7 y falla cardiaca.8 Se han hecho esfuerzos para clasificar los quimioterapéuticos con base en su potencial efecto cardiotóxico;1,9,10 sin embargo, han resultado clasificaciones ambiguas por la diversidad de efectos que puede ocasionar un mismo fármaco, lo cual ha hecho difícil el abordaje de este problema.
En el caso de las antraciclinas se reconocen tres síndromes de daño cardiaco: cardiotoxicidad aguda (síndrome pericarditis-miocarditis), cardiotoxicidad crónica de instalación temprana y cardiotoxicidad crónica tardía.2 Esta última es la más frecuente (se presenta a partir del año del inicio del tratamiento), así como la que correlaciona mejor con la dosis acumulada del fármaco.11
Cuando se empezó a utilizar la epirubicina, en 1980, en Francia (aprobada por al FDA en 1999), se pensó que era una mejor alternativa que la doxorubicina para evitar la cardiotoxicidad, pero actualmente, aunque la dosis acumulada sea mayor en la epirubicina, también lo es la dosis terapéutica; por lo que al final ambos medicamentos son muy similares en su perfil cardiotóxico.12 Por lo que muchos de los efectos adversos cardiovasculares de la doxorubicina se han generalizado a todo el grupo de las antraciclinas.
La ifosfamida es un caso diferente. Pertenece a la clase de los agentes alquilantes y sus efectos cardiovasculares son mucho menos comunes que en el caso de las antraciclinas. Sin embargo, se presentan con mayor frecuencia en pacientes que previamente recibieron antraciclinas, 9 como es el caso aquí presentado; la falla cardiaca es una de las características que presentan; a diferencia de las antraciclinas, es reversible en muchos casos.13
A pesar de las importantes diferencias en la fisiopatología y la presentación de estos efectos, son pocas las guías sobre cómo se deben de evaluar los pacientes que van a recibir o recibieron estos medicamentos; aunado a que dichas guías no marcan diferencias claras entre los diferentes abordajes para los diferentes fármacos.14,15 Por otra parte, sería lógico encontrar diferencias importantes debido a la gran variedad de efectos y tiempos de presentación.
Actualmente existe un gran número de estudios que evalúan diferentes aproximaciones al problema;16 algunos promueven el uso de biomarcadores como troponinas o péptido natriurético cerebral (BNP),17-19 otros sugieren el uso de métodos de imagen.20-22 Recientemente, el Doctor Ewer MS, del hospital MD Anderson, advirtió del gran problema que es no tener definiciones claras sobre qué es lo que se estudia, ya que la definición sobre un evento cardiaco adverso presenta una gran variación de un estudio a otro.23
CASO CLÍNICO
Mujer de 45 años de edad, originaria y residente de la Ciudad de México. Vive en casa propia con todos los servicios intra y extrahospitalarios. Negó hacinamiento. Consumo de alcohol y tabaco negado. Actividad física: sedentarismo. Religión: católica. Estado civil: casada. AHF: padre portador de cáncer hepático sin otra especificación, falleció por complicaciones no especificadas. Dos hijos sanos. Resto interrogado y negado. APP: alergia a la penicilina. Esclerosis múltiple intermitente remitente diagnosticada en 1990 en tratamiento con interferón alfa, última crisis dos años previos sin secuelas. Linfoma B difuso de células grandes sin otra especificación diagnosticado en junio 2011. Recibió primero tratamiento con R CHOP (rituximab + ciclofosfamida + doxorubicina + vincristina + prednisona) seis ciclos.
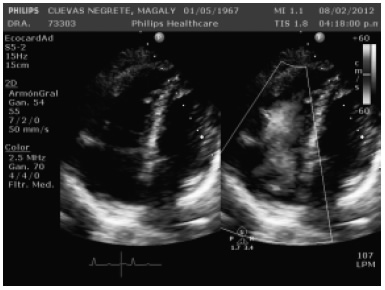
Persistió con actividad tumoral, por lo que se inició tratamiento con R-ICE (rituximab + ifosfamida + carbopaltino + etoposido) tres ciclos. En febrero 2012 se diagnosticó insuficiencia cardiaca secundaria probablemente a tratamiento quimioterapéutico. Con ECOTT dilatación de cavidades derechas (Figura 1), FEVI 45%, insuficiencia tricúspide moderada, TPSE 13 y PSAP de 78 mmHg. Se trató como falla cardiaca aguda y respondió a tratamiento en la Unidad Coronaria. No se pudo determinar la causa de la insuficiencia cardiaca, pero en los meses posteriores, la paciente presentó mejoría de la función ventricular izquierda, pero persistió con datos de falla cardiaca derecha.
CONCLUSIÓN
Es de gran importancia determinar cuál de los fármacos ocasionó la falla cardiaca; por un lado está la doxorubicina, la cual causa falla cardiaca irreversible, y por el otro está la ifosfamida, la cual causa falla cardiaca reversible. Se requieren estudios que determinen nuevas formas de evaluar la cardiotoxicidad en los pacientes oncológicos; así como prevenir la aparición de estos cuadros, ya que en el caso de las neoplasias hematológicas, el paciente sobrevive al problema primario, falleciendo finalmente por las complicaciones del tratamiento. Éste es un momento de oportunidad para el desarrollo de protocolos sobre cardiotoxicidad en oncología, sobre todo porque el Hospital Médica Sur cuenta con un gran número de pacientes, tratamientos de vanguardia, infraestructura y personal para llevar a cabo este tipo de estudios.
ABREVIATURAS
- AHF: antecedentes heredo-familiares.
- APP: antecedentes patológicos del paciente.
- BNP: péptido natriurético cerebral.
- ECOTT: ecografía transtorácica.
- FDA: Food Drug Administration.
- FEVI: volumen espiratorio máximo en el primer segundo (forced expiratory volume in 1 second).
- PSAP: presión sistólica en la arteria pulmonar.
REFERENCIAS
- Brana I, Tabernero J. Cardiotoxicity. Ann Oncol 2010 (s7): 173-9.
- Singal PK, Iliskovic N. Doxorubicin induced cardiomyopathy. NEJM 1998; (24): 900-4.
- Yoon GY, Telli ML, Kao DP, Matsuda KY, et al. Left ventricular dysfunction in patients receiving cardiotoxic cancer therapies. J Am Coll Cardiol 2010; 56(20): 1647-50.
- Ewer S, Ewer MS. Cardiotoxicity profile of trastuzumab. Drug Safety 2008; 31(6): 459-67.
- Mellor HR, Bell AR, Valentin JR. Cardiotoxicity associated with targeting kinase pathways in cancer. Toxicol Sci 2011; 120(1): 14-32.
- Gupta R, Maitland ML. Sunitinib, hipertensión, and heart failure: A model for kinase inhibitor mediated cardiotoxicity. Curr Hypertens Rep 2011; 13(6): 430-5.
- Pantaleo MA, Mandrioli A, Saponara M. Development of coronary artery stenosis in a patient with metastatic renal cell carcinoma treated with sorafenib. BMC Cancer 2012.
- Sandra MS, Frederick SW, Ewer MS. Congestive heart failure in patients treated with doxorubicin. Cancer 2003; 97(11): 2869-79.
- Edward TH, Ann TT, Daniel JL, Wamique Yusaf, et al. Cardiovascular complications of cancer therapy: Diagnosis, patogénesis and Management. Circulation 2004; 109: 3122-31.
- Albi A, Pennesi G, Donatelli F, Cammarota R. Cardiotoxicity of anticancer drugs: The need for cardio oncology and cardio oncological prevention. J Natl Cancer Inst 2010; 2010(102): 14-25.
- Cardinale D, Colombo A, Lamantina G, Colombo N, et al. Anthraycline induced cardiomyopathy. J Am Coll Cardiol 2010; 55(3): 213-9.
- Khasraw M, Bell R, Dang Ch. Epirubicin: Is it like doxorubicin in breast cancer? A clinical review. The Breast 2012; 1: 1-8.
- Zenaide Quezado, Wyndham H. Wilson Robert E. Cunnion, et al. High dose ifosfamide is associated with severe, reversible cardiac dysfunction. Ann Intern Med 1993: 118(1): 31-6.
- Steinherz LJ, Graham T, Hurwitz R, et al. Guidelines for cardiac monitoring of children during and after anthracycline therapy: Report of the Cardiology Comitee of the Childrens Cancer Study Group. Padiatrics 1992; 89; 942.
- Bovelli D, Platonitis G, Riola F. Cardiotoxicitiy of chemotherapeutic agents and radiotherapy related heart disease: ESMO clinical practice guidelines. Ann Oncol 2010; 2010 (5): 277-82.
- Altena R, Perik PJ, Van Veldhuisen DJ. Cardiovascular toxicity caused by cancer treatment: strategies for early detection. Lancet Oncol 2009; 10: 391-9.
- Romano, Frantini S, Ricevuto E, Procaccini V, et al. Serial mesurments of NT proBNP are predicitve of anthracycline cardiotoxicity in breast cancer patients. Br J Cancer 2011; 105 (11): 1663-8.
- Feola M, Garrone O, Ocelli M, et al. Cardiotoxicity after anthracycline chemotherapy in breast carcinoma: Effect on left ventricular ejection fraction, Troponin I and brain natriuretic peptide. Int J Cardiol 2011; 148: 194–8.
- Ewer MS, Ewer SM. Troponin I provides insight into cardiotoxicity and the anthracycline-Trastuzumab interaction. J Clin Oncol 2010; 28(25): 3901-4.
- Ho E, Brown A, Barrett P, et al. Subclinical anthracycline and trastuzumab induced cardiotoxicity in the long term follow up of asymptomatic breast cancer survivors: a speckle tracking echocardiographic study. Heart 2010; 701-7.
- Fallah–Rad N, Walker JR, Wassef A, et al. The utility of cardiac biomarkers, tissue velocity and strain imaging, and cardiac magnetic resonance imaging in predicting early left ventricular dysfunction in patients with Her2 positive breast cancer treated with adjuvant trastuzumab therapy. J Am Coll Cardiol 2011; 57 (22): 2263-70.
- Edvardsen T. Can Modern echocardiographic techniques predict drug induced cardiotoxicity. J Am Coll Cardiol 2011; 57(22): 2271-2.
- Verma S, Ewer MS. Is cardiotoxicity being adequately assessed in current trials of cytotoxic and targeted agents in breast cancer? Ann Oncol 2011; 22: 1011-8.

